Synthetische Biologie - neue Pläne für das Leben
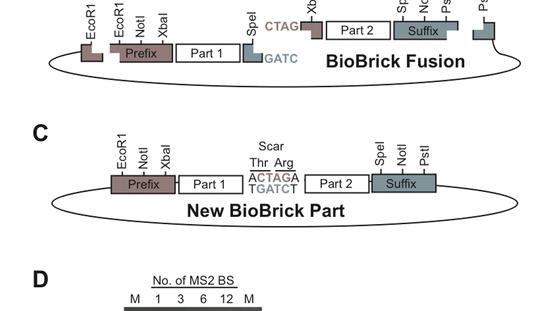
Das Prinzip der Zusammenfügung von Biobricks. Bild aus: A Biobrick Library for Cloning Custom Eukaryotic Plasmids.PLOS / Constante et al./CC-BY-SA-2.5
Die synthetische Biologie nutzt die Grundbausteine des Lebens, um neue Substanzen und Systeme zu erzeugen
Biologen lernen von Ingenieuren: Die synthetische Biologie will das Genom und den Stoffwechsel planvoll umbauen und für den Menschen nutzbar machen. Biokraftstoffe, auf Naturstoffen basierende Medikamente oder sogar synthetische Lebensformen sind das Ziel. Vieles wird wohl Utopie bleiben, aber manches könnte unser Leben spürbar verändern.
Die Biologie ist traditionell eine Wissenschaft, die sich weitgehend auf das Beobachten beschränkt. Erst in den 1970er Jahren entwickelten Molekularbiologen Methoden, mit denen sie gezielt in das Erbgut von Zellen eingreifen konnten. Zunächst blieben diese Eingriffe jedoch auf einzelne Gene beschränkt. Heute ist die Gentechnik so weit vorangeschritten, dass ganze Stoffwechselvorgänge und Signalwege manipuliert werden können. Ein neuer Zweig der Biologie hat sich daher ein ehrgeiziges Ziel gesetzt: Nicht mehr nur beobachten, sondern auch neu erschaffen. Um das Jahr 2000 herum fand sich auch eine passende Bezeichnung für das Feld - synthetische Biologie.
Bald stellten sich die ersten Erfolge ein. Mit großem Medienecho wurde 2010 ein angeblich "synthetisches Lebewesen" vorgestellt, dessen Erbgut aus Synthesemaschinen stammte (Gibson et al., Science 2010: Creation of a Bacterial Cell Controlled by a Chemically Synthesized Genome). Weniger medienwirksam - aber vielleicht mit größerer Tragweite - war die Erschaffung eines recodierten Organismus, der einem umprogrammierten genetischen Code gehorcht (Genomisch recodierte Organismen - nützlich und harmlos). Und den grundsätzlichen Beweis, dass synthetische Biologen praxistaugliche Produkte entwickeln können, lieferte ein Medikament: Das Malariamittel Artemisinin, ursprünglich aus einer seltenen Pflanzenart gewonnen, kann seit 2006 in Hefen erzeugt werden (Ro et al., Nature 2006: Production of the antimalarial drug precursor artemisinic acid in engineered yeast).
Die synthetische Biologie vereint Wissenschaftler aus vielen Disziplinen, und da verwundert es nicht, dass eine einheitliche Definition unmöglich ist. Selbst Experten sind sich untereinander nicht einig - jeder versteht unter synthetischer Biologie etwas anderes (Nature Biotechnology 2009: What’s in a name?). Doch der zentrale Punkt ist unstrittig: Die synthetische Biologie will etwas Neues schaffen, das es so in der Natur nicht gibt. Als Vorbild dienen Ingenieure, die einen Bauplan entwerfen und auf dieser Grundlage neue Maschinen konstruieren. Vorgefertigte Teile oder Module - oft mit Legosteinen verglichen - spielen in diesem Konzept eine zentrale Rolle.
Organismen sollen aus BioBricks zusammengebaut werden
Die Legosteine spielen auf den englischen Begriffs "BioBricks" an: Eigenständige Module, die Forscher aus einzelnen Proteinen oder einfachen Stoffwechsel- und Signalvorgängen erzeugen. BioBricks werden zentral gespeichert, indem die entsprechenden Gene (in der Form von isolierter DNA) in einer Art Bank hinterlegt werden. Andere Forscher können die BioBricks anfordern, sie nach Belieben kombinieren und so vielschrittige Stoffwechselprozesse oder komplexe Signalketten aus ihnen formen.
Dieser Ansatz der synthetischen Biologie möchte neue Systeme erzeugen - von Grund auf (er wird daher oft als "Bottom-up" bezeichnet). Damit dies funktionieren kann, brauchen die Forscher einen Minimalorganismus: Ein Lebewesen, das nur die notwendigsten Gene enthält und eine möglichst störungsfreie Umgebung darstellt, in der sich die BioBricks entfalten können. Forscher träumen davon, auf diese Weise kleine Fabriken zu erzeugen, die Medikamente oder Biokraftstoffe ausstoßen. Denkbar sind auch Biosensoren, die Schadstoffe in der Umwelt aufspüren oder Infektionen erkennen und bekämpfen. Den Minimalorganismus gibt es noch nicht, aber manche Forscher arbeiten mit Hochdruck an seiner Entwicklung.
BioBricks hingegen werden bereits seit Jahren fleißig produziert. 2004 startete eine unabhängige Organisation, die International Genetically Engineered Machine (iGEM) Foundation, im US-amerikanischen Cambridge einen internationalen Wettbewerb: Studenten bilden Teams und bearbeiten selbstgewählte Projekte, die Module für die synthetische Biologie erzeugen sollen. Auf einer großen Abschluss-Veranstaltung konkurrieren die Teams dann um Medaillen und Preise. Erfolgversprechende Module werden eingereicht und in der Standard Registry of Biological Parts gespeichert. Im Laufe der Jahre ist der iGEM Wettbewerb zu beachtlicher Größe herangewachsen: Zuletzt haben 190 Teams teilgenommen, die mehr 1800 Module eingereicht haben. Deutsche Teams waren ebenfalls dabei - und oftmals auf den vorderen Plätzen zu finden.
Doch der Fokus des iGEM Wettbewerbs liegt nicht auf der Erstellung von BioBricks, sondern auf der Ausbildung von Studenten. Und das ist der wissenschaftlichen Qualität nicht zuträglich. Die Studenten haben nur einen Sommer Zeit für Projekte, die selbst erfahrene Forschergruppen oft viele Jahre Arbeit kosten. Und so haben die iGEM-Teilnehmer zwar schon tausende Module eingereicht, aber nur die wenigsten wurden auch auf Funktionsfähigkeit getestet. Viele dieser Module sind vermutlich nicht brauchbar.
Der Bottom-up-Ansatz kämpft noch mit einem anderen Problem - in der lebenden Zelle sind alle Vorgänge miteinander vernetzt. Aber Module funktionieren nur dann reibungslos, wenn in einem System alle Teile säuberlich voneinander getrennt sind. In einer Zelle ist das Gegenteil der Fall: Hier beeinflusst der Grund-Stoffwechsel die Module, und die Module stören sich gegenseitig. Unerprobte Kombinationen können überraschende Effekte hervorrufen. Derartige Probleme können nur mit großem Aufwand gelöst werden, große Fortschritte auf diesem Gebiet sind daher in den nächsten Jahren nicht zu erwarten.
Metabolic Engineering
Es gibt noch einen weiteren Zweig der synthetischen Biologie, der deutlich weiter fortgeschritten ist. Bei dem "Top-down"-Ansatz werden Zellen nur in den Teilen verändert, die für das Vorhaben relevant sind. Dieser Ansatz ist schon wesentlich älter, da er auch mit den Methoden der klassischen Gentechnik zu realisieren war. Das metabolic engineering etwa befasst sich schon seit vielen Jahren mit der Optimierung von Stoffwechselvorgängen. Doch die Methoden der synthetischen Biologie haben diesem Feld eine neue Qualität verliehen: Die Herstellung des Malariamittels Artemisinin zum Beispiel beruht nicht auf der Optimierung eines bestehenden Prozesses, sondern erforderte die Kombination von unterschiedlichen Enzymen zu einem neuen Stoffwechselweg.
Andere Top-down-Ansätze wie das protein engineering profitieren ebenfalls von den neuen Methoden, so dass hier die Grenzen zwischen klassischer Gentechnik und synthetischer Biologie schwammig werden. Auf diesen Gebieten sind die ersten konkreten Erfolge zu erwarten: Artemisinin ist bereits in der industriellen Herstellung, an der Produktion von Biokraftstoffen durch veränderte Bakterien wird intensiv geforscht. Hier könnte die synthetische Biologie bald Auswirkungen haben, die auch im täglichen Leben spürbar sind.
Sythetische Organismen?
Doch nicht jeder synthetische Biologe gibt sich mit Details wie Modulen und Optimierungen zufrieden. Im Jahr 2010 synthetisierte der Genomforscher J. Craig Venter das gesamte Erbgut des Bakteriums M. mycoides und verpflanzte es in die verwandte Art M. capricolum - das Erbgut verwandelte das Empfänger-Bakterium in die Art M. mycoides. Venter nannte dies eine "synthetische Zelle" und implizierte damit, dass er künstliches Leben erschaffen habe (Der nächste Schritt der Gottwerdung). Und der Genom-Pionier George Church machte sich daran, eine seit Jahrmilliarden bestehende Konstante der Natur zu verändern. Er programmierte Teile des genetischen Codes um und erzeugte einen recodierten Organismus, der neuartige Proteine produzieren kann.
Diese Entwicklungen sind nicht ohne Risiken. Veränderte Organismen könnten in die Umwelt gelangen und sich dort unkontrolliert vermehren oder ihre veränderten Gene an andere Lebewesen weitergeben - eine potentielle Gefahr für Mensch und Umwelt. Aber im Moment sind diese Risiken schwer zu definieren: Ein echter synthetischer Organismus ist Jahre entfernt, und die aktuellen Gefährdungen unterscheiden sich kaum von denen, die man aus der klassischen Gentechnik kennt. Das ist vielleicht mit ein Grund, warum dieses Thema im öffentlichen Bewusstsein fast keine Rolle spielt.
Die synthetische Biologie gehört zu den jüngsten Disziplinen der Naturwissenschaften, in den meisten Bereichen steckt sie sogar noch in den Kinderschuhen. Ihre wenigen konkreten Erfolge lassen jedoch erahnen, welches Potenzial in ihr steckt. Viele Top-down-Ansätze der synthetischen Biologie werden sich durchsetzen, das kann man getrost prophezeien. Doch ob sie auch ihre kühnen Bottom-up-Utopien verwirklichen kann, wird sich erst in den nächsten Jahrzehnten zeigen.
Teil 2: Das synthetische Genom - ein Schritt zum Minimalorganismus.
