Selbstdüngung mit Hilfe von Designer-Bakterien
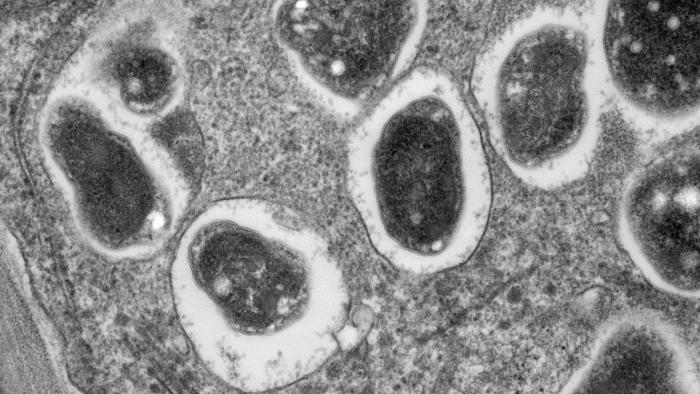
Elektronenmikroskopische Aufnahme des Querschnitts eines Wurzelknöllchens der Sojabohne, das Bradyrhyzobium japonicum-Bakterien enthält. Die Bakterien infizieren die Wurzeln und ermöglichen so die stickstofffixierende Symbiose. Bild: Louisa Howard - Dartmouth Electron Microscope Facility, gemeinfrei
- Selbstdüngung mit Hilfe von Designer-Bakterien
- "Die Evolution ist auf unserer Seite"
- Auf einer Seite lesen
Synthetische Biologie soll Mikroorganismen für die Landwirtschaft optimieren und die Bindung von Stickstoff aus der Luft auch für dafür bisher nicht geeignete Pflanzen zugänglich machen
Der deutsche Agrarchemiekonzern Bayer und die US-Amerikaner von Ginkgo Bioworks haben Mitte September 2017 die Schaffung eines gemeinsames Unternehmens angekündigt, das das Potential der synthetischen Biologie bei der Verbesserung von Mikroorganismen ausloten wird. Optimierte Bodenbakterien sollen Pflanzen, die selber nicht dazu in der Lage sind, befähigen, eine eigene Stickstoffdünger-Produktion im Mini-Maßstab zu fahren. Mittel der Wahl: Knöllchenbakterien im Wurzelreich, die Stickstoff aus der Luft fixieren und in geeigneter Form an ihre Wirtspflanzen weiterreichen können.
Doch Nutzpflanzen wie Mais, Weizen und Reis etwa sind für eine solche Symbiose nicht geeignet. Hier soll das noch namenlose Start-Up-Unternehmen Abhilfe schaffen - mit einem Anfangskapital von 100 Millionen US-Dollar, das von den Mutterfirmen und von Investoren stammt. Die Bemühungen sind Teil neuerer landwirtschaftlicher Forschungen, die die Möglichkeiten von in Pflanzen und im Boden lebenden Mikroorganismen aufbohren wollen. Ein Teilziel: die Erhöhung der Erträge, bei gleichzeitiger Rücknahme des Düngemittelaufwands.
In der Landwirtschaft wird viel Geld in Stickstoffdünger gesteckt. Der gleicht die Verluste im Boden aus, die der Anbau von Feldfrüchten mit sich bringt. Ein Problem dabei: eine kosteneffiziente Stickstoffbereitstellung für die Wurzelsysteme, ohne Umweltschäden durch Düngemittelausschwemmungen zu provozieren. Die künstliche Düngung mit mineralischen Stickstoffdüngern gilt als wesentliche Quelle der steigenden Nitratbelastung des Grundwassers. Außerdem ist ihre Herstellung über das Haber-Bosch-Verfahren mit 37.4 GJ pro Tonne Ammoniak (2000) energieintensiv: 3% der weltweiten Kohlenstoffemissionen werden heute der Stickstoffdüngemittelproduktion zugerechnet.
Bei diesen Problemen setzt das Vorhaben an. Im Erfolgsfalle könnte es darüber hinaus das weltweite Geschäft mit Stickstoffdüngern auf den Kopf stellen, das einen Umfang von 80 Milliarden US-Dollar jährlich ausmacht.
Seit langem gesucht: Naturnahe Verfahren, die das Stickstoffreservoir der Erdatmosphäre energieeffizient anzapfen können
Erbsen, Erdnüsse, Lupinen, Klee und Soja sowie eine Reihe weiterer Pflanzen können Vorteile aus einer symbiotischen Beziehung mit bestimmten im Boden und im Pflanzengewebe lebenden Mikroorganismen erzielen. Knöllchenbakterien sind deren bekanntesten Vertreter: sie sind in der Lage, Stickstoff aus der Luft zu binden und in Ammoniak umzuwandeln, das so für die Pflanzen in Form von Ammoniumsalzen verfügbar wird.
Molekularer Stickstoff ist relativ inert. Im Gegensatz zu anderen Molekülen mit einer Dreifachbindung ist er unpolar und bietet Reaktionspartnern nicht ohne weiteres einen Angriffspunkt. Erst bei Annäherung an die Bedingungen im elektrischen Lichtbogen zerfällt er in seine Atome. Dabei ist die auf Naturbeobachtung basierende Anwendung der Stickstofffixierung zur Bodendüngung in der Landwirtschaft frühzeitig überliefert, aus Südostasiens beispielsweise ab 2000 v.u.Z., wo die Symbiose von stickstofffixierenden Cyanobakterien mit Algenfarnen im Reisanbau genutzt wurde - die Algenfarne wachsen parallel zum Reis mit und sorgen für eine Verbesserung der Stickstoffbilanz. Den Römern wiederum war die Optimierung der Erträge durch Fruchtfolgen mit Leguminosen bereits um 300 v.u.Z. bekannt.
Der Agrarchemiker Hermann Hellriegel und sein Assistent Hermann Wilfarth entdeckten 1886 in Bernburg die Bindung von freiem Luftstickstoff durch Knöllchenbakterien in den Wurzelknöllchen von Hülsenfrüchtlern. Die Entdeckung gilt als Sternstunde in der Chemie der Landwirtschaft - mit ihr wurde die zentrale Rolle erkannt, die die Bakterien bei der Fixierung des Luftstickstoffs spielen, und die lange beobachtete Stickstoffgewinne beim Leguminosenanbau hatten endlich ihre Erklärung.
Der Mensch versucht seit geraumer Zeit, der Natur ihr Geheimnis für den Kunstgriff der Verwandlung von Luftstickstoff in Ammoniak zu entlocken und in ein handhabbares Verfahren zu verwandeln. Seine bisherige Lösung, die großindustrielle Ammoniaksynthese nach dem Haber-Bosch-Verfahren, bedient heute fast den kompletten weltweiten Ammoniakbedarf, doch sie kommt vergleichsweise grobschlächtig daher: das Verfahren arbeitet unter sehr unphysiologischen Bedingungen, nämlich bei ca. 300 bar und 500° C.
Mikroorganismen gelingt fast die gleiche Reaktion bei Zimmertemperatur und unter Normaldruck. Sie bringen die für die Stickstofffixierung nötigen Enzyme mit. Am bekanntesten sind die symbiotisch mit höheren Pflanzen zusammenlebenden Mikroorganismen aus der Bakteriengruppe der Rhizobien, die in Leguminosen die bekannten Wurzelknöllchen bilden, oder Frankia alni-Bakterien, die in den Wurzeln von beispielsweise Erle, Ölweide und Sanddorn die gleiche Funktion haben. Solche Symbionten binden schätzungsweise 50 - 150 kg Luftstickstoff pro Hektar und Jahr. Frei lebende Stickstofffixierer wie Azotobacter oder und Cyanobakterien kommen auf jährlich 1 - 5 kg Stickstoff pro Hektar.
Doch nicht alle Nutzpflanzen sind zur Symbiose mit stickstofffixierenden Mikroorganismen in der Lage - eine ganze Reihe von ihnen sind für die Symbionten keine guten Gastgeber. Doch sie könnten künftig dazu gebracht werden - mit Stickstoff produzierendem Mikrobiom aus dem Labor. Ob diese Art von Starthilfe überhaupt funktioniert, ist noch völlig unklar. Die Beantwortung dieser Frage gilt als eine der Hauptherausforderungen des Vorhabens. Jason Kelly, Ginkgo-Mitbegründer und CEO: "Was für uns spricht: die Pflanze will unbedingt diesen Stickstoff, und geschichtlich gesehen ist das genau das richtige Szenario, damit eine symbiotische Beziehung entsteht. Die Evolution ist auf unserer Seite."
