Von Hund zu Mensch: KI erkennt Krebs in der Pathologie
Tierproben helfen auch dem Menschen bei der Krebserkennung mittels KI in der Pathologie – und das ganz ohne Tierversuche.
Pathologie findet nicht nur im Labor oder im Sektionssaal statt, sondern auch am Bildschirm, da Gewebeproben digitalisiert werden.
(Bild: tilialucida/Shutterstock.com)
Wer mit KI forschen will, benötigt qualitätsgesicherte Daten in großer Menge. Diskutiert dabei wird, woher die medizinischen Forschungsdaten kommen, wer alles auf Gesundheitsdaten im Zentralen Datenportal zugreifen darf, wie generell mit Gesundheitsdaten und dem Datenschutz umgegangen wird und wem die Gesundheitsdaten gehören. Dabei müssen es nicht immer Menschen sein, die Daten für die medizinische Forschung liefern. Auch mit Tierdaten lässt sich zum Beispiel in der Pathologie eine KI zum Erkennen von Krebs bei Tier und Mensch trainieren – ganz ohne Tierversuche.
Inter-Spezies-Transfer zwischen Tier und Mensch
Forschung ist nicht immer auf Primärdaten angewiesen, die zielgerichtet und aktiv für Studien erhoben werden. Auch mit Sekundärdaten, die als Routinedaten bei der Diagnostik und Versorgung anfallen, lässt sich forschen. Professor Marc Aubreville beschäftigt sich seit 2016 mit dem Thema der algorithmisch unterstützten Pathologie und forscht dazu an der Technischen Hochschule Ingolstadt. Für das Training von KI-Modellen für die Histopathologie nutzen er und weitere Kooperationspartner nur Routine-Diagnostikdaten. Der größte Teil davon stammt nicht von Menschen, sondern aus der medizinischen Behandlung von Haustieren wie Hund und Katze.
Obwohl sich Tiere und Menschen unterscheiden, gibt es Parallelen auf Zellebene: "Am Ende soll unsere Forschung lebenden Wesen zugutekommen, und daher ist es gut, mit repräsentativen Daten für diesen Anwendungsfall zu arbeiten" sagt Aubreville. Dort, wo die biologische Parallelität groß ist, lassen sich Ergebnisse von Tier auf Mensch und umgekehrt übertragen und in Anwendungen für die Praxis bringen. Studien haben gezeigt, dass KI-Modelle, die auf Tierdaten trainiert wurden, auch auf menschlichen Geweben gute Ergebnisse erzielen können. Beispielsweise konnte ein auf Hunde-Brustkrebs trainierter Algorithmus zur Erkennung von Zellteilungen auch auf menschlichem Brustkrebsgewebe erfolgreich angewendet werden.
Pathologische Wahrheit basiert auf Mustererkennung
KI kann Krebs nicht nur in der Radiologie erkennen, sondern auch bei anderen bildgebenden Verfahren eine Hilfe sein. In der Histopathologie findet die gesicherte Diagnostik von Tumorerkrankungen statt, in dem Gewebe- und Zellproben in Form von aufbereiteten Gewebeschnitten unter dem Mikroskop im Detail untersucht werden. Der Pathologe sucht dabei nach Auffälligkeiten und Mustern auf zellulärer Ebene. Die Diagnostik basiert auf Mustererkennung. Denn bestimmte Muster stehen für bestimmte Pathologien.
Videos by heise
Erkennt der Pathologe ein Muster, kann er auf eine Krankheit schließen. Auch die Verteilung und Konzentration der pathologischen Zellen lässt Schlüsse auf den Charakter des Tumors, den Verlauf und die Prognose zu. Dabei kann die Analyse einer Probe mehrere Tage bis Wochen dauern. Bei Krebsverdacht wertet der Pathologe die Mitoseaktivitäten auf Zellebene aus. Die Mitose ist ein Prozess der Zellteilung. Befindet sich eine Zelle gerade im Prozess der Zellteilung, spricht man von einer Mytotischen Figur (MF).
Kommt es zu einer Fehlregulation des Prozesses, können Zellen unkontrolliert wachsen und sich vermehren, was zur Entstehung und Ausbreitung von Tumoren führt. Krebszellen zeichnen sich oft durch eine erhöhte Proliferationsrate aus, das heißt, sie teilen sich schneller und häufiger als normale Zellen. Das spiegelt sich in einer erhöhten Anzahl von MF im Gewebe wider. Pathologen haben verschiedene Methoden, um die Mitoseaktivität zu bewerten. Sie zählen die MF als Mitotic Count (MC) und stellen das Verhältnis der MF zu den anderen Zellen, die sich nicht in Mitose befinden als Mitotic Index (MI) fest.
Um die Aggressivität des Tumors besser einschätzen zu können, bestimmen sie mit dem Volume Corrected Mitotic Index (M/V-Index) die Anzahl der MF pro Volumeneinheit des Tumorgewebes. Neben normalen MFs gibt es seltener auch noch atypischen MFs, die auf eine aggressivere Tumorbiologie hinweisen. Die Identifizierung und Quantifizierung von MFs kann aufgrund ihrer komplexen Morphologie schwierig sein und zu abweichenden Bewertungen zwischen Pathologen bei der Suche nach der pathologischen Wahrheit in der Probe führen.
Digitale Pathologie braucht robuste Algorithmen
Pathologie ist ein in großen Teilen manuelles Verfahren und ein Erfahrungsberuf. Die Auswertung eines histopathologischen Präparats auf der Suche nach krebsverdächtigen Zellen, also die MF, könne man sich wie die Suche nach Hydranten in einem Satellitenbild mit einer ganz hohen Auflösung vorstellen, erklärt Aubreville. Es ist ein sehr zeitaufwendiges Verfahren für Menschen, für das auch Konzentration nötig ist. KI kann Pathologen dabei unterstützen, ihre Diagnosen schneller, genauer und effizienter zu treffen. Dazu müssen die auf einem Objektträger fixierten Gewebeschnitte zunächst von einem Whole Slide Image Scanner (WSIS) digitalisiert werden. Algorithmen können darauf trainiert werden, die MF in den digitalisierten Gewebeschnitten (Whole Slide Image, WSI) automatisch zu erkennen, zu zählen und ihre Verteilung und Muster visuell für den Pathologen schnell sichtbar zu machen.
Tierpathologie mit KI-Unterstützung (3 Bilder)
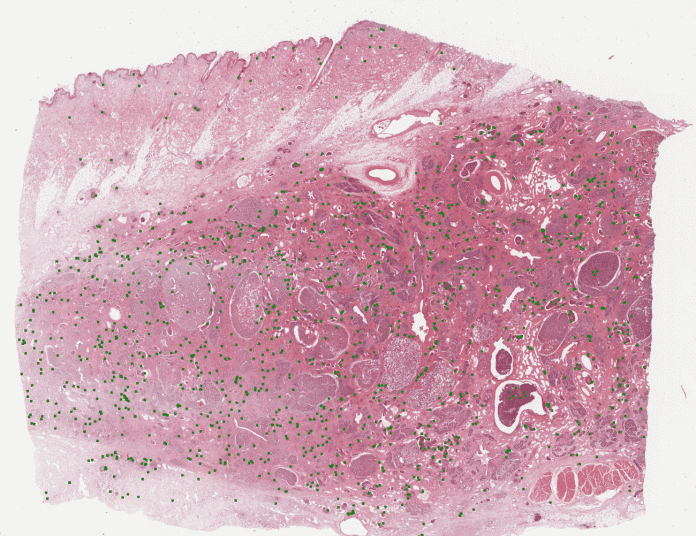
Ein solches WSI einer Gewebeprobe für die Forschung kann schon mal die Auflösung von 300.000 Pixel × 300.000 Pixel haben. Um ein einziges WSI vollständig und richtig zu annotieren, sind mehrere Monate Arbeit nötig. Um die Genauigkeit der Annotationen zu erhöhen und Fehler zu reduzieren, wird ein WSI nicht von einem, sondern von mehreren Pathologen annotiert und überprüft.
Empfohlener redaktioneller Inhalt
Mit Ihrer Zustimmung wird hier ein externes YouTube-Video (Google Ireland Limited) geladen.
Ich bin damit einverstanden, dass mir externe Inhalte angezeigt werden. Damit können personenbezogene Daten an Drittplattformen (Google Ireland Limited) übermittelt werden. Mehr dazu in unserer Datenschutzerklärung.
Abgesehen von der Annotation ist auch die Qualität des Materials eine Herausforderung für KI. Es gibt zwar Standards, aber von der Probenentnahme über die Probenvorbereitung bis hin zum fertigen Scan viele Einflussfaktoren. Abweichungen kommen in Form der Variabilität von Gewebetypen und -schnitten, Färbemethoden und auch den eingesetzten Scannern vor. "Wir entwickeln einerseits KI-Algorithmen, die inhärent robuster sind und steigern andererseits die Probenheterogenität, um hier ein realistisches Abbild der Praxis zu erreichen", sagt Aubreville. Denn sonst kann jeder Domain-Shift, der während des Prozesses von der Probe bis zum digitalen Bild zu Variationen in dem Trainingsmaterial führt, auch zu einem drastischen Abfall der Detektionsrate der KI in der Praxis führen.
Internationaler Austausch von Tierdaten
Um mit diagnostisch erhobenen Proben und Daten von Menschen zu arbeiten, brauchen die Forscher nicht nur deren Einwilligung, sondern auch die Genehmigung einer Ethikkommission. Tierproben lassen sich für die Forschung aktuell leichter beschaffen und handhaben, denn es sind weder Einwilligung noch ein Ethikantrag nötig. Mit Tierdaten gibt es eine größere und vielfältigere Datenbasis. Diese wird von der Research Group des AIMI Lab – Artificial Intelligence in Medical Imaging der Friedrich-Alexander-Universität (FAU) und The Ingolstadt Medical Imaging Group der Technischen Hochschule Ingolstadt auf deepmicroscopy.org auch anderen Forschern frei zur Verfügung gestellt. Um für die Forschung einen Überblick über biomedizinische KI-Modelle zu schaffen, wurde von der FAU das "AIMe-Register" als Community-gesteuerte Berichtsplattform aufgebaut.
International gibt es nicht nur Projekte, sondern auch Medical image analysis challenges. Im Rahmen einer Mitosis Domain Generalization Challenge (MIDOG) wurde 2021 durch Aubreville und weitere beteiligte Forschungspartner ein Mitose-Detektor entwickelt, der aktuell am Uniklinikum Utrecht als diagnostische Zusatzhilfe erprobt wird.
(mack)