Die Ordnung des Universums: 150 Jahre Periodensystem der Elemente
Vor 150 Jahren wurde der wegweisende Vortrag zur "Abhängigkeit der chemischen Elemente von ihrem Atomgewicht" gehalten.
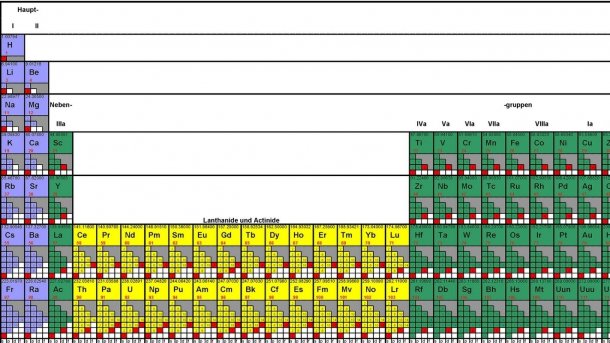
Der Vortrag, den ein gewisser Nikolai Alexandrowitsch Menschutkin am 6. März 1869 vor der Russischen Chemischen Gesellschaft hielt, sollte die Geschichte der Naturwissenschaft nachhaltig verändern: Menschutkin berichtete über die Arbeiten seines Lehrers Dmitri Mendelejew aus Sankt Petersburg zur "Abhängigkeit der chemischen Elemente von ihrem Atomgewicht". Die Tabelle, die er dabei vorstellte, ist heute als Periodensystem der Elemente bekannt. Mendelejew selbst war an diesem Abend verhindert – er inspizierte eine Käserei südlich von Moskau.
Das Periodensystem stellt bis heute in den senkrecht angeordneten "Gruppen" ähnliche Elemente zueinander. Zum Beispiel gehören zu den Alkalimetallen unter anderem Lithium, Natrium, Kalium und Cäsium. In den waagerechten "Perioden" sind die Elemente nach der Ordnungszahl – der Zahl der Protonen im Atomkern – gruppiert.
Keine Nobelpreise
Nur wenige Monate später veröffentlicht der deutsche Chemiker Lothar Meyer ein ganz ähnliches Schema. Zunächst ist offen, welches System sich durchsetzen wird. Meyer und Mendelejew erhalten für ihre Forschung 1882 gemeinsam die prestigeträchtige Davy-Medaille. Doch verblasst zumindest außerhalb von Chemikerkreisen der Name Meyer mit der Zeit. Und obwohl er zwischen 1905 und 1907 immer zu den aussichtsreichsten Kandidaten zählt, erhält jedoch auch der Russe nie den Chemie-Nobelpreis.
Die wissenschaftliche Leistung, die hinter der Erstellung des Periodensystems steckt, war dennoch enorm. Denn weder Mendelejew noch seinem deutschen Kollegen waren die zu Grunde liegenden physikalischen Prinzipien bekannt – Protonen, Neutronen und der Zusammenhang der chemischen Eigenschaften mit der Konfiguration der äußeren Elektronen eines Elementes sollten erst Jahrzehnte später entdeckt werden. Bis in Mendelejews Zeit wurden Elemente etwa abhängig von Farbe, Leitfähigkeit oder thermischen Eigenschaften geordnet.
Ordnung nach Atomgewicht ging nicht gänzlich auf
In rund 20 Jahren systematischer Arbeit erkannte der russische Chemiker jedoch, dass die zunächst naheliegend erscheinende Ordnung nach Atomgewicht nicht gänzlich aufging: Tellur zum Beispiel musste er nach Jod platzieren, obwohl Jod leichter ist. Bei der Lösung, die Mendelejew angeblich zuerst im Traum erschien, platzierte er die Elemente schließlich wie Karten in einer Patience – inklusive freier Plätze, für die er die Entdeckung damals noch unbekannter Stoffe postulierte: Eka-Silicium etwa Eka-Aluminium oder Eka-Bor.
Tatsächlich wiesen die später entdeckten Elemente Scandium, Gallium und Germanium die vorhergesagten Eigenschaften auf. Als 1894 das Edelgas Argon entdeckt wird, verneint Mendelejew zunächst dessen Existenz – weil er dafür einfach keine Lücke in seinem System findet. Für ihn ist es ein "neuer Bestandteil der Luft". Doch als auch Gase mit ähnlichen Eigenschaften wie Radon und Neon entdeckt werden, bekommen Edelgase ihren Platz – in einer eigenen Spalte.
118 Elemente bekannt
Mittlerweile sind 118 Elemente bekannt. Doch auch 150 Jahre nach Mendelejews Entdeckung haben die Forscher die Suche nach neuen Elementen nicht aufgegeben. Die Suche ist allerdings sehr viel mühsamer geworden: Da sich die Protonen im Atomkern elektrisch abstoßen, werden Elemente ab einer Ordnungszahl von 80 instabil – sie sind radioaktiv und zerfallen. Elemente mit einer Ordnungszahl jenseits von 94 können nur künstlich hergestellt werden, indem man mit Beschleunigern Kerne schwerer Elemente aufeinander schießt, um so neue Elemente zu bilden. Die so erzeugten Elemente sind jedoch sehr kurzlebig. Jenseits der Ordnungszahl 114 entdeckten die Forscher jedoch eine Insel der Stabilität.
Auch heute sind russische Forscher auf diesem Feld weit vorne mit dabei. Im Flerov Laboratory of Nuclear Reactions in Dubna, in dem insgesamt neun superschwere Elemente hergestellt wurden, entstand auch das bislang schwerste Element mit der Ordnungszahl 118: Organesson. Kern und Elektronen dieses superschweren Elementes verhalten sich anders als bei leichteren Elementen. Die Wissenschaftler vermuten, dass ihnen das Studium dieser superschweren Elemente daher wertvolle Hinweise auf den Aufbau der Materie geben kann. Das Labor will noch in diesem Jahr seine Superheavy Element Factory in Betrieb nehmen. Ob das Periodensystem noch weiter anwächst, wird wohl die Zeit zeigen. Und die Fähigkeiten der Labore. (mit Material der dpa) / (axk)