Retina-Implantate: Ohne Support erblinden Patienten wieder
Wenn die Hersteller medizinischer Implantate ihre Produkte nicht mehr unterstützen, verlieren die Patienten ein Stück wieder gewonnene Lebensqualität.
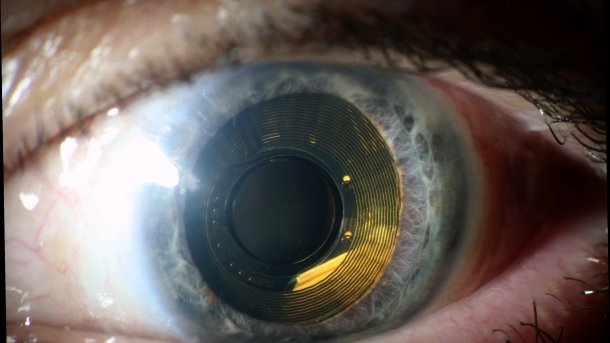
Eine vom Fraunhofer IMS entwickelte Sehprothese für Retinitis pigmentosa hat in klinischen Studien gezeigt, dass sie den erblindeten Patienten wieder ein wenig Sehkraft zurück geben kann. Sie ist allerdings noch nicht auf dem Markt.
(Bild: Universität Duisburg-Essen/Fraunhofer IMS)
- Enno Park
Wenn ein Smartphone-Hersteller keine Sicherheitsupdates mehr zur Verfügung stellt, ist das ärgerlich, aber relativ einfach zu beheben: Man kauft sich ein neues Smartphone und hat dabei die Auswahl aus einer Vielzahl von Modellen verschiedenster Hersteller in allen möglichen Preisklassen. Passiert dasselbe mit einem medizinischen Implantat, sieht die Lage etwas anders aus, berichtet die neue Ausgabe 7/2022 von MIT Technology Review.
Diese Erfahrung mussten blinde Patienten in mehreren Ländern – darunter auch Deutschland – machen, denen ein Retina-Implantat zunächst zu einem rudimentären elektronischen Sehsinn verholfen hatte. Das Implantat funktionierte aber nur solange, bis der US-amerikanische Hersteller Second Sight den Kundensupport einstellte. Das Unternehmen hatte Millionenverluste eingefahren und wurde von einem Konkurrenten übernommen. Der hatte kein Interesse an den Implantaten und wechselte das Geschäftsgebiet. Damit verloren Patienten ihr mühsam zurückerlangtes Augenlicht ein zweites Mal, sobald ihr Implantat ausfiel. Betroffen ist auch der US-Amerikaner Terry Byland. "Wenn etwas damit schiefgeht, bin ich aufgeschmissen. Weil es keine Möglichkeit gibt, es repariert zu bekommen", sagte Byland gegenüber dem IEEE-Spektrum-Magazin.
Medizinische Implantate: Meist proprietäre Technik verwendet
Das Retina-Implantat von Second Sight besteht neben dem Implantat noch aus einer Brille mit einer eingebauten Kamera und einem kleinen Computer, der am Gürtel getragen wird, sowie aus Kabeln, die das Ganze miteinander verbinden. Hat ein solches Kabel einen Wackelkontakt, kann dadurch das ganze System unbrauchbar werden. Da meist proprietäre Technik verwendet wird, können sich die Betroffenen normalerweise nicht mit Standardteilen aus dem Elektronikmarkt helfen, sondern sind auf den Herstellersupport angewiesen.
Videos by heise
Selbst wenn es irreparabel ist und die Patienten sich damit abfinden, wieder erblindet zu sein – ein Implantat, dass stillgelegt im Körper verweilt, kann durchaus für Probleme sorgen. So vertragen sich viele Implantate nicht mit Magnetresonanztomografen und müssen für die Dauer einer MRT- Untersuchung explantiert werden. Kunden von Second Sight hatten die Anweisung, in diesem Fall die Firma vor der Durchführung der Untersuchung zu kontaktieren. Doch die ist auch für Radiologen nicht mehr zu erreichen.
Leider ist Second Sight kein Einzelfall. 2019 beendete beispielsweise die Firma Autonomic Technologies ihre Geschäftstätigkeit. Sie stellte Implantate zur Bekämpfung von anders nicht behandelbaren Cluster-Kopfschmerzen her, die im Fall einer Schmerzattacke von den Patienten per Fernbedienung eingeschaltet werden. Gibt die Fernbedienung ihren Geist auf, müssen die Patienten trotz des vorhandenen Implantats die Kopfschmerzen ertragen oder anderweitig versuchen, sie zu behandeln.
Handhabe gegen gefährliche Implantate vorhanden
Dass solche Versorgungslücken durch Firmenpleiten möglich sind, ist die Folge einer Regulierungslücke. Die Medizinprodukterichtlinie der EU und die deutsche Medizinprodukteverordnung schreiben Anbietern von medizinischen Implantaten eine Reihe von Pflichten vor. Doch diese Regeln zielen darauf ab, dass medizinische Implantate ihren Nutzern schaden könnten und geben dem Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) eine Handhabe, um gefährliche Implantate nach entsprechender Risikobewertung vom Markt nehmen. Für Betreuung betroffener Patienten, wenn die Hersteller den Support einstellen, sind weder das Bundesgesundheitsministerium noch das BfArM oder die Landesbehörden zuständig. Das wird dem Markt und der Ärzteschaft überlassen.
Hier MIT Technology Review lesen:
- Lesen Sie den vollständigen Artikel "Wenn es plötzlich wieder dunkel wird" im Browser bei MIT Technology Review
- MIT Technology Review 7/2022-Printausgabe im heise shop bestellen
- Ab 29.9. im gut sortierten Zeitschriftenhandel kaufen
(jsc)