Transplantation: Schweineherzen bald für Menschen
Erstmals gelang die Transplantation eines Schweineherzens. Schwer Herzkranke könnten künftig schneller ein gesundes Ersatzorgan bekommen.
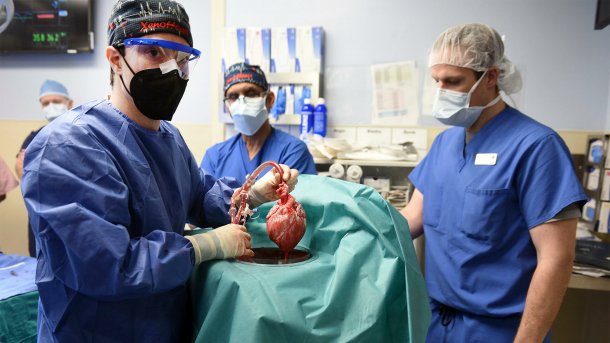
Das erste Schweineherz, das einem Menschen eingepflanzt wurde, haben die Chirurgen in Maryland unter den gleichen OP-Bedingungen aus dem Schwein extrahiert, unter denen jede Herz-OP stattfindet.
(Bild: University of Maryland)
Weshalb gerade David Bennett als Patient weltberühmt werden sollte, kann niemand so genau erklären. Jedenfalls stellte Muhammad Mohiuddin, Direktor des Herztransplantationszentrums am Medical Center der University of Maryland, bei der amerikanischen Arzneimittelzulassungsbehörde FDA einen Antrag auf "Anwendung aus Mitgefühl" für Bennett: Er sollte der erste Mensch werden, dem ein Schweineherz transplantiert wird.
Bennett war ein 57-jähriger Handwerker mit fortgeschrittener Herzschwäche und Rhythmusstörungen. An seinem Zustand war er selbst nicht unbeteiligt – seine Ärzte bemängelten, dass er sich nicht an die verordneten Therapien gehalten habe und nicht mitgeholfen habe, seinen Blutdruck unter Kontrolle zu bekommen. Also verweigerten sie ihm die Transplantation. Spenderorgane seien zu selten und kostbar, als dass sie jemandem gegeben würden, der sich vermutlich anschließend nicht ordentlich darum kümmere, sagte Mohiuddin.
Allein in Deutschland verlängerte sich letztes Jahr die "Warteliste Herz" der Vermittlungsstelle Eurotransplant um 522 Menschen. 329 auf der Liste bekamen eine neue Pumpe, 86 verstarben, während sie warteten. In den USA hofften derweil rund 3500 Menschen auf ein Herz. Einer von ihnen war Bennett.
Videos by heise
Langer Weg zur Xenotransplantation
Am 7. Januar 2022 entfernte der Chirurg Bartley Griffith in Maryland also Bennetts krankes Herz und setzte ihm stattdessen das eines Schweines in den Brustkorb ein. Zwei Monate später, am 8. März, starb Bennett. Dennoch feierte die wissenschaftliche Gemeinschaft diese Operation als großen Schritt auf dem langen, steinigen Weg zur Xenotransplantation – der Übertragung von Organen zwischen zwei Spezies. "Damit hat die Xenotransplantation die Komfortzone der Wissenschaft verlassen und sich in die raue Welt der Klinik gewagt", sagt Bruno Reichart von der LMU München. Der hochdekorierte Herzchirurg ist einer der Treiber der deutschen Xenotransplantationslandschaft und mit seiner Forschung Teil des seit 2012 geförderten Sonderforschungsbereichs "Biologie der xenogenen Zell- und Organtransplantation". "David Bennett war extrem krank. Die Chance, dass er die Operation selbst überlebt, lag sicherlich bei unter 50 Prozent", schätzt er. Deshalb sei es durchaus kein Misserfolg, dass der Patient nach zwei Monaten verstorben sei.
Allerdings war diese Operation nicht automatisch der Startschuss für Schweine als Organspender. "Regulatorisch betrachtet war das ein sogenannter Heilversuch", sagt Ralf Tönjes, Leiter der Forschungsgruppe Xenogene Zelltherapeutika am Paul-Ehrlich-Institut (PEI) in Langen. "Das war nicht Teil einer klinischen Studie, aber ist definitiv ein erster großer Schritt für die Xenotransplantation von Organen, Geweben und Zellen vom Schwein zum Menschen." Von der FDA wird dieser Heilversuch sogar als so erfolgreich gewertet, dass die Zulassungsbehörde an einer neuen Richtlinie für Xenotransplantationen arbeitet – an deren Formulierung sind auch zwei Forscher des deutschen Sonderforschungsbereichs beteiligt. Und sie zieht in Erwägung, demnächst erste klinische Studien zu Xenotransplantationen zuzulassen. Klinische Studien sieht Tönjes für Deutschland und Europa allerdings in der nächsten kürzeren Zeit noch nicht – und über seinen Schreibtisch würde ein solcher Antrag gehen. Aber man sei am PEI vorbereitet. Xenogene Zelltherapien seien im Arzneimittelgesetz in Paragraf 21 geregelt und genetisch modifizierte Schweinezellen erfasst das Gesetz als Advanced Therapy Medicinal Products, kurz ATMPs.
Ähnlich reicht nicht
Schweine als Organspender sind schon seit Jahrzehnten im Gespräch. Sie sind uns physiologisch und genetisch recht ähnlich. Sie lassen sich gut züchten und halten. Allerdings ist bereits eine Allotransplantation, also eine Organübertragung von Mensch zu Mensch, eine diffizile Angelegenheit, denn unser Immunsystem ist Fremdem gegenüber wenig aufgeschlossen: Näht ein Chirurg ein fremdes Herz, eine Niere oder auch nur ein paar Inselzellen der Bauchspeicheldrüse in seinen Patienten ein, stößt das Immunsystem das fremde Gewebe energisch und sehr schnell ab. Transplantationspatienten nehmen in der Regel ihr Leben lang Medikamente ein, die das Immunsystem dämpfen – selbst wenn Blutgruppe und Gewebefaktoren von Spender und Empfänger ausgezeichnet zueinander passen.
Auch wenn Schweine uns ähneln, sind ihre Zellen und Gewebe anders strukturiert als unsere. Sie tragen andere Moleküle auf ihren Oberflächen und produzieren andere Stoffwechselprodukte. Das macht die Übertragung von Schweineorganen oder Geweben auf Menschen noch ein Stück komplizierter.
In den 90er-Jahren stand es schon einmal recht gut um die Xenotransplantation. Forschenden war es gelungen, durch genetisch veränderte Schweine die Gewebeabstoßungen zu verringern. Auf deren Zellen fehlten für viele Säugetiere – auch für Schweine – typische Zuckermoleküle: Galaktose-alpha-1,3-Galaktose, kurz Alpha-Gal. Ein Trigger für das Immunsystem. Er sorgt dafür, dass Immunzellen das Schweinegewebe innerhalb kürzester Zeit durch eine hyperakute Abstoßungsreaktion vernichten. Die Community war voller Hoffnung, dass Schweine damit demnächst nicht nur Speck und Steaks für unsere Teller, sondern auch Herzen, Nieren, Lungen, Lebern und Inselzellen für unsere Chirurgen liefern würden. Und dann kamen die PERV.
(Bild: Ralf Reinhard Tönjes / American Society for Microbiology)
Der virale Mikrokosmos des Schweins
PERV ist die Abkürzung für porcine endogene Retroviren. Retroviren sind Viren, die sich in das Genom ihrer Wirtszellen hineinschreiben, und endogen bedeutet, dass sie über die Keimbahn weitervererbt werden. Humane endogene Retroviren, HERVs, machen etwa fünf bis acht Prozent des gesamten menschlichen Genoms aus. Sie sind Teil unserer Evolutionsgeschichte und einige von ihnen stehen in Verdacht, mit Krebserkrankungen zusammenzuhängen. Als die PERV in Schweinen entdeckt wurden, sorgten sich die Forschenden, dass die Schweine-Viren die Organempfänger infizieren. Organe, die ihren Empfänger mit Viren infizieren, wären das Aus für jede Transplantation.
"Schweine sind niemals frei von PERV", sagt Tönjes. "In der Regel tragen auch die meisten Schweine replikationskompetente PERV, und wir wissen seit 20 Jahren, dass diese PERV im besten Fall in der Kulturschale menschliche Zelllinien infizieren können." Von PERV gehen – da ist sich die Xenoforschungsgemeinschaft inzwischen einig – wohl keine Gefahren für die Patienten aus. "Es gibt keinen Menschen auf der Welt, der je mit PERV infiziert wurde", sagt Reichart. "Schlachter baden in Schweineblut und wir haben eine Antikörperstudie unter Schlachtern durchgeführt. Keiner hat Antikörper gegen PERV. Aber es ist natürlich eine Möglichkeit und man muss das im Blick behalten."
Und es gibt nicht nur PERV. Schweine haben ihren eigenen bakteriellen und viralen Mikrokosmos. Sie tragen auf Schweine angepasste Viren in sich, die – wenn sie mit dem Organ in den Körper gepflanzt werden – unkalkulierbare Auswirkungen haben könnten. Auch in Bennett wurde ein solches Virus gefunden und wird als Todesursache gehandelt: Die Schweinevariante des Cytomegalie-Virus (pCMV), das auch als menschliche Variante bei Allotransplantationen für viele Rückschläge sorgt. Das Perfide: Das Schwein war auf pCMV getestet. Negativ selbstverständlich. "Die Tests des US-amerikanischen Untersuchungslabors waren offensichtlich nicht geeignet, um latente pCMV zu detektieren", sagt Tönjes und fügt selbstbewusst hinzu: "Wir hätten es gefunden, denn wir haben im Konsortium Methoden, um solche pCMV nachzuweisen. Das wäre also vermeidbar gewesen."
High-Tech-Schweine
Als die Viren ins Spiel kamen, bedeutete das einen herben Rückschlag für die Xenotransplantation. "Es sind viele Firmen abgesprungen", erinnert sich Björn Petersen. Er entwickelt am Institut für Nutztiergenetik des Friedrich-Löffler-Instituts in Mariensee Schweine für Xenotransplantationen. "Novartis beispielsweise hatte ein großes Xenotransplantationsprogramm in Cambridge. Die haben alles eingestellt, da ihnen die Virenproblematik zu heiß war."
Und nun ist die Xenotransplantation wieder da. Die hyperakute Abstoßungsreaktion haben die Forschenden im Griff; die Viren ebenso. Der wichtigste Knackpunkt, der derzeit noch Anträge zu klinischen Studien verhindert, sind die Schweine selbst. Nicht weil sich das Spender-Schwein für Bennetts Herz als ungeeignet herausgestellt hätte, sondern aus einem anderen Grund: "Wenn Sie ein Arzneimittel beantragen, um es für die Anwendung am Menschen in Verkehr zu bringen, dann müssen sämtliche Untersuchungen und Prüfungen einheitlich gewesen sein. Das bedeutet in diesem Falle, man kann nicht für den einen Patienten dieses Schwein nehmen und für den anderen Patienten ein anderes Schwein", sagt Tönjes. Natürlich seien zwei Schweine für zwei Patienten nötig – nur müssten diese Schweine identische genetische Modifikationen haben. Es würde sozusagen eine genetisch stabile und homogene Schweinelinie als Arzneimittel zugelassen.
Schweineherz mit zehn veränderten Genen
Um bei Bennett in Maryland zu bleiben: Er bekam das Herz eines 10-GE-Schweins von der Firma Revivicor aus Blacksburg in Virginia, einer Tochter des Biotech-Unternehmens United Therapeutics Corporation. 10-GE heißt nichts weiter als "genetically engineered" mit zehn veränderten Genen. Davon sind vier Knock-outs – also ausgeschaltete Gene – und sechs Transgene – neu hineingeschriebene genetische Informationen. "Revivicor ist einer der ältesten Mitspieler auf dem Feld. Sie sind aus der Firma PPL Therapeutics entstanden, die damals Dolly und später die ersten Schweine geklont haben", sagt Petersen. Viele der genetischen Veränderungen, die das Herz für Bennett trug, hat das deutsche Konsortium als erste getestet. Und auch für Xenotransplantationen an Pavianen hat Reichart Revivicor-Schweinezellen aus den USA importiert und die Schweine hier geklont.
Aber auch wenn man 10-GE-Schweine bei Revivicor kaufen kann, gibt es keine 10-GE-Schweinelinie. Das Kriterium dafür ist, dass die zehn genetischen Modifikationen sich rein über Zucht erhalten lassen. Noch gelingt das nicht, noch müssen genetische Veränderungen immer wieder frisch eingebaut und die Schweine dann über Klonen reproduziert werden. Petersen hat in seinem Schweinestall um die 100 Tiere, die nur für die Entwicklung der Xenotransplantation gezogen sind. Darunter sind welche mit Sechs-, Sieben- und Achtfach-Modifikationen. Das Problem ist: Wenn Petersen ein Gen ausknockt, also einfach nur deaktiviert, ist die Veränderung klar lokalisiert – das Gen ist kaputt, fertig.
"Wenn Sie aber fünf verschiedene Transgene einzeln in das Genom einbauen wollen, dann integriert sich das eine hier im Genom, das andere dort. Die neuen Gene können andere Gene beeinflussen, die wichtig sind. Die können an Genorten integrieren, die vielleicht stillgelegt sind und nicht abgelesen werden", beschreibt Petersen die Problematik. Auch werden längst nicht alle Veränderungen an die Nachkommen weitergegeben. Also koppelt er die Gene aneinander. "Dann schneidet man mit CRISPR/Cas bevorzugt in einem Gen, was man ohnehin ausschalten möchte, und versucht diese Gen-Kassette dort zu integrieren." Bis das alles geschafft ist und die ersten Nachkommen dieser Schweine das Licht der Welt erblicken, vergeht etwa ein Jahr. Werden neu eingeführte Gene in der Zucht unfreiwillig wieder ausgeschaltet, müssen sie wieder neu eingebaut werden. Dann kann es sein, dass sie sich an anderer Stelle integrieren, und schon hat man ein anderes Schwein mit einem anderen Genom. Und immer noch keine zulassungsfähige Schweinelinie.
"Das größte Hindernis sind Investoren."
Neben Petersen am FLI, der staatlich finanziert für die Gesellschaft forscht, und Revivicor, das sich sein Alpha-Gal-Knock-out unter dem Namen GalSafe hat patentieren lassen, entwickelt noch das Biotech-Unternehmen eGenesis Schweine für Xenotransplantationen. Es wurde von George Church gemeinsam mit Luhan Yang 2018 gegründet, um PERV-freie Schweine durch ein CRISPR/Cas-Knock-out zu erzeugen. "Die haben unheimlich viele Patente für den Einsatz von CRISPR/Cas im Zusammenhang mit Xenotransplantation", sagt Petersen. Weitere Patente hält Makana Therapeutics, und auch Recombinetics, eine Firma, die bisher genetische Modifikation für Tiergesundheit in Nutztiere eingebracht hat, ist inzwischen auf den Xenotransplantationszug aufgesprungen. Was die Vielzahl von Patenten, die bei unterschiedlichen Firmen liegen, letztlich für die Vermarktung von Schweineorganen für die Transplantation bedeuten wird, wird sich erst zeigen, wenn die Zulassungshürde genommen ist.
Unabhängig vom deutschen Forschungskonsortium mischt nun auch Reichart mit einem Spin-off der LMU München in der Xeno-Schweinezucht mit: X-Transplant soll die Xenotransplantation in die Klinik führen. Zum einen ist Reichart der Überzeugung, dass gar nicht so viele Genmodifikationen nötig sind, wie Revivicor einbaut. "Für Xenotransplantationen, bei denen Schweineherzen in Paviane transplantiert werden, reichen drei", weiß Reichart durch zwei Langzeitstudien. "Wir gehen davon aus, dass wir beim Menschen mit fünf auskommen, weil einige der 10-GE-Modifikationen redundant sind. Allein aus regulatorischen Gründen ist es besser, sich auf wenige Genmodifikationen zu beschränken, weil man für jede Modifikation nachweisen muss, wie sie wirkt und dass es keine Nebenwirkungen gibt." Probleme, die nicht durch die Genmodifikationen behoben werden – wie Entzündungen oder Gerinnungsstörungen – möchte Reichart lieber medikamentös lösen. Medikamente könne man absetzen, wenn man sie nicht mehr brauche, Gene nicht.
(Bild: Eckhard Wolf)
Welche Schweinerasse?
Ein weiterer wichtiger Grund für seine eigene Zucht sind die Schweinerassen, die in den wichtigsten Xeno-Zuchten derzeit verwendet werden: Landrasse-Schweine. Ein solches Schwein wird um die 300 Kilogramm schwer und hat ein entsprechend großes Herz. Das Wachstum muss also gebremst werden. Bei seinen Pavian-Transplantationen hat Reichart das mit dem Zellwachstumshemmstoff Rapamycin erreicht, "aber für die Klinik brauchen wir Schweinerassen, die nicht so groß sind." Das Revivicor-Schwein, das Bennett sein Herz gespendet hat, war ein sogenanntes Laron-Schwein mit einem Wachstumshormonrezeptor-Knock-out. Aber diese Schweine verfetten sehr stark und sind als Zuchttiere wenig geeignet, weil mit der Verfettung die Fruchtbarkeit schwindet. Reichart setzt deshalb auf neuseeländische Auckland-Island-Schweine. Eine kleine verwilderte Hausschweinrasse, die ehemals lebender Schiffsproviant war und nur 70 bis 90 Kilogramm schwer wird.
Wenn bisher nur von Herzen die Rede war, hat das den einfachen Grund, dass das Herz als besonders einfaches und robustes Organ gilt. "Es ist nur ein Hohlmuskel, der Wasser ansaugt und pumpt. Eine Niere ist dagegen schon wahnsinnig kompliziert. Die filtert, scheidet aus, rückresorbiert, produziert ein Hormon, das Erythropoetin, das beim Schwein auch noch etwas anders aussieht als beim Menschen", sagt Reichart. Die Leber als zentrales Stoffwechselorgan, das Nährstoffe verwertet, Giftstoffe abbaut und Gerinnungsfaktoren für das Blut produziert, ist so hochspezialisiert, dass eine Xeno-Leber weit, weit entfernt ist.
"Das Endziel ist natürlich, genetisch veränderte Schweine zu haben, von denen man das Herz, die Niere, Inselzellen und vielleicht die ganze Bauchspeicheldrüse nehmen kann", sagt Petersen. "Aber wenn man versucht, alle Probleme auszugrenzen, kann es sein, dass wir bei so vielen genetischen Modifikationen landen, dass das nicht mehr mit einer normalen embryonalen Entwicklung oder einem normalen Leben des Schweins vereinbar ist. Wir werden sehen, ob es ein Universal-Spender-Schwein geben kann oder ob wir unterschiedliche Linien für unterschiedliche Organe haben werden."
Nächste Schritte
Wie auch immer das ausgeht – durch die Operation an David Bennett ist ein Damm gebrochen. Es gibt erfolgreiche Langzeitexperimente in Primaten mit Herzen und sogar Nieren. (Auch mit Inselzellen, die an der Bauchspeicheldrüse Insulin produzieren – aber das sind genau genommen Gewebe und keine Organe.) Es gibt diese erste Erfahrung am Menschen. Die Tierzucht kann xenotaugliche Tiere bereitstellen. Stellt sich die Frage: Wie oft müssen diese vorklinischen Schritte noch gegangen werden?
Das PEI sagt im Behördendeutsch dazu, dass die bisherigen in Fachzeitschriften veröffentlichten Daten – zum Beispiel Von-Schwein-auf-Pavian-Transplantationen – zum Zeitpunkt eher nicht eine zeitnah zu erwartende Einreichung auf klinische Prüfungen im Rahmen von Xenotransplantationen nahelegen. Tönjes wird konkreter: "Wir können davon ausgehen, dass dieses und nächstes Jahr keine Anträge auf klinische Prüfungen bei uns eingereicht werden." Denn solange dauert es allein, eine stabile 5-GE-Schweinelinie zu erzeugen, die Reichart plant. Und diese Schweine müssen dann auch wieder in Pavian-Transplantationen ihre Eignung beweisen.
Aber das Konsortium um Reichart ist auf dem Sprung. "Das größte Hindernis sind Investoren", klagt er. "Der bayrische Staat fördert uns gerade mit 400.000 Euro. Um Pilotstudien an vier Patienten zu machen, brauchen wir ein paar Millionen. Allein eine Herztransplantation kostet in Deutschland 200.000 Euro." Dennoch bereitet er schon mal den Antrag für die Studie beim PEI vor. "Es dauert etwa ein Jahr, bis Fragen geklärt sind, wie die OP aussehen muss, was für Gewebeproben genommen werden müssen – das sind Punkte, die wir schon im Vorfeld klären können, dafür brauchen wir keine fertigen Tiere." Knabbern die ersten Ferkel aus einer stabilen 5-GE-Schweinelinie in ihrem Hochsicherheitsstall sterilisiertes Heu, wird Reichart bereit sein.
(jsc)